|
Bestimmung der Sauerstoffkonzentration
|
Die Sauerstoffbestimmung wird nach Winkler durchgeführt. Der Sauerstoffgehalt eines Gewässers ist wichtig für die Aussage der ökologischen Situation. Diese Situation ist heutzutage sehr bedenklich. Viele Gewässer werden vom Menschen genutzt und stark belastet, dadurch kann die Lebensgemeinschaft (zwischen den einzelnen Organismen, wie Pflanzen und Tiere) gestört werden. Hinzu kommen noch die Luftschadstoffe.
|
|
Für die Sauerstoffbestimmung benötigt man die folgenden Materialien:
|
|
Geräte:
|
- Winklerflasche (Glasflaschen mit abgeschrägtem Schliffstopfen und einem genau bekannten Volumen) 2Meßpipetten (1 ml)
Bürette
Erlenmeyerkolben (250 ml)
|
|
Materialien:
|
- Manganchlorid- Lösung (8 g MnCl2 · 4H2O in 10ml Wasser)
alkalische Kaliumiodid- Lösung (5g NaOH und 4g Kl in 10ml Wasser)
2 ml konzentrierte Phosphorsäure
|
|
Entnahme der Wasserprobe:
|
|
Mit der Winklerflasche wird an verschiedenen Stellen und Tiefen des Teiches, mit Hilfe der vorher beschriebenen Instrumente, Wasser entnommen. Es sollte beachtet werden, dass kein zusätzlicher Sauerstoff in die Flasche gelangt. Die Winklerflasche wird unter Wasser gefüllt und dort sollte sie dann auch mit dem Stopfen verschlossen werden, um die Bildung von Blasen zu vermeiden. Zusätzlich wird die Temperatur der unterschiedlichen Wasserstellen gemessen.
|
 |
|
Versuchsdurchführung:
|
|
Zu der entnommenen Wasserprobe werden 0,5ml Manganchlorid- Lösung hinzugefügt, hierbei ist zu beachten, dass die Messpipette, in der das Manganchlorid ist, ganz auf den Flaschengrund geführt wird. Denn bei der Hinzuführung läuft etwas Wasser über, es wird vermeiden, dass die Lösung mit rausfließt. Hinzu muss dann noch 1ml der Kaliumiodid- Lösung. Die Flasche wird so verschlossen, dass keine Luft über der Probe steht und anschließend wird sie vorsichtig geschüttelt und dann ca. 10min. stehen gelassen.
In der Zeit wird die Bürette mit destilliertem Wasser einige Male ausgespült. Im folgenden Schritt wird die Wasserprobe in den Erlenmeyerkolben gefüllt und 2ml Phosphorsäure werden hinzugefügt.
Die vorhandene Lösung wird mit Natriumthiosulfat titriert, bis sich die Farbe ändert. Anschließend wird an der Skala der Bürette abgelesen wie viel Natriumthiosulfat hinzugefügt werden musste, bis die Substanz neutralisiert ist.
|
|
Versuchsbeobachtung:
|
 |
|
Wasserprobe des Teiches in einer Winklerflasche:
Im unteren Teil der Flasche setzt sich ein schwerlöslicher Niederschlag ab, der obere Teil ist klar durchsichtig.
|
|
|
Nach der Zugabe der Kaliumiodid- Lösung färbt sich die Wasserprobe gelb bis gelbbraun
|
 |
|
Nach der Neutralisierung mit Phosphorsäure ist die Probe klar geworden und der Niederschlag hat sich aufgelöst:
|
|
|
Deutung der entstandenen Farbveränderungen
|
|
Nach der Zugabe der Kaliumiodid- Lösung, färbt sich die Wasserprobe gelb bis gelbbraun. Dies wird durch das entstandene Jod ausgelöst. Auf dem oberen Bild ist deutlich zu erkennen das die Intensität der Farben unterschiedlich ist. Je stärke die Farbe ist, desto mehr Jod und somit auch Sauerstoff ist in der Wasserprobe enthalten.
Die Verfärbung bei der Zugabe von Natriumthiosulfat lässt sich auf die Jod zurück zu führen.
|
|
 |
|
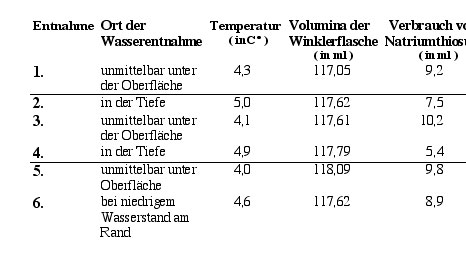
Wenn man die Tabelle betrachtet kann man hinsichtlich der Temperatur erkennen, dass diese immer im oberen Teil des Teiches im Durchschnitt 4 C∞ beträgt und im unterem Teil um ca. 1 C∞ sinkt. Der Verbrauch von Natriumthiosulfat ist bei den Gruppen, welche die Wasserprobe in der Nähe der Wasseroberfläche entnommen haben, um ca. 2- 3 ml größer, als bei den Gruppen, die die Wasserprobe in der Tiefe entnommen haben.
|
|
Berechnung der Sauerstoffkonzentration
|
|
Erläuterung an einem Beispiel
-Natriumthiosulfat- Lösung: 0,01 mol
-Verhältnis von Natriumthiosulfat und Sauerstoff:
-Der Verbrauch von 4 mol Thiosulfat zeigt 1 mol Sauerstoff an
|
|
Gruppe 1:
0,01 mol auf 1000 ml Natriumthiosulfat
0,00001 mol auf 1 ml Natriumthiosulfat
0,000092 mol auf 9,2 ml Natriumthiosulfat
9,2 ml Thiosulfat-Lösung entsprechen 0,000092 / 4 mol Sauerstoff.
0,000023 mol Sauerstoff befinden sich in 117,05 ml
In dieser Probe (117.05 ml) waren 0,000023 mol Sauerstoff gelöst .
|
| demnach ist die Konzentration des gelösten Sauerstoffs : |
| 1000 / 117.05 x 0,000023 mol/l = 0,0002 mol/l |
|
Reaktionsgleichungen:
|
|
Bei Zugabe Lösung von Manganchlorid:
|
|
4 Mn2+ + O2- + 8 OH- +2 H20-----> 4Mn(OH)3 (gelöster Sauerstoff wird chemisch gebunden)
|
| Einrichten der Reaktionsgleichung siehe hier>>>>> |
|
|
Bei Zugabe von Kaliumiodid:
|
|
4 Mn3+ + 4 I- -----> 4 Mn2+ + 2I2 (Freisetzung von Iod)
|
|
Bei Zugabe der Natriumthiosulfatlösung:
|
|
2 I2 + 4 S2O32- -----> 4 I- + 2 S4O62- (Entfärbung)
|
|
|
Weitere Gründe für die unterschiedlichen Sauerstoffkonzentrationen:
In der Tiefe ist weniger Sauerstoff vorhanden, da die Konsumenten, z.B. Tiere sich zu einem Teil von Pflanzen ernähren und dieses bedeutet wiederum einen zusätzlichen Sauerstoffverbrauch.
Produzenten, wie z.B. Algen sind wichtige Parameter, die für die Sauerstoffzunahme in den oberen Bereichen eines Teiches verantwortlich sind, da sie Sauerstoff abgeben.
|
|
Zusätzlich werden im Uferbereich und in der lichtdurchflutenden Wasserschicht
eines solchen nährstoffreichen Sees mehr organische Substanzen erzeugt, als in der Zehr- und Bodenschicht wieder abgebaut werden können. Die Sauerstoffkonzentration kann am Grunde des Gewässers so stark zurückgehen, dass überwiegend anaerobe Zersetzungsprozesse ablaufen. Hierbei entstehen ausgedehnte Faulschlammschichten. Vom flachen Ufer dringen Schilfgürtel, Schwimmblatt- und Unterwasserpflanzen immer mehr in den See vor.
Außerdem ist die Sommer- und Winterstagnation zu beachten. Die Temperaturunterschiede zwischen Tag und Nacht bedingen während der Sommerstagnation Umwälzungen in den oberen Wasserschichten, so dass es hier zu weitgehend ausgeglichen Temperatur-, Gas- und Nährstoffverhältnissen kommt. Bei den eintretenden Vollzirkulationen während der Winterstagniaion kommt es zu einem Austausch von sauerstoffreichem, kohlenstoffdioxid- und nährstoffarmen Oberflächenwasser und dem sauerstoffarmen, kohlenstoffdioxid- und
nährstoffreichen Tiefenwasser. Somit ist das Sauerstoffverhältnis nicht ausgeglichen.
|